Przykład 2.
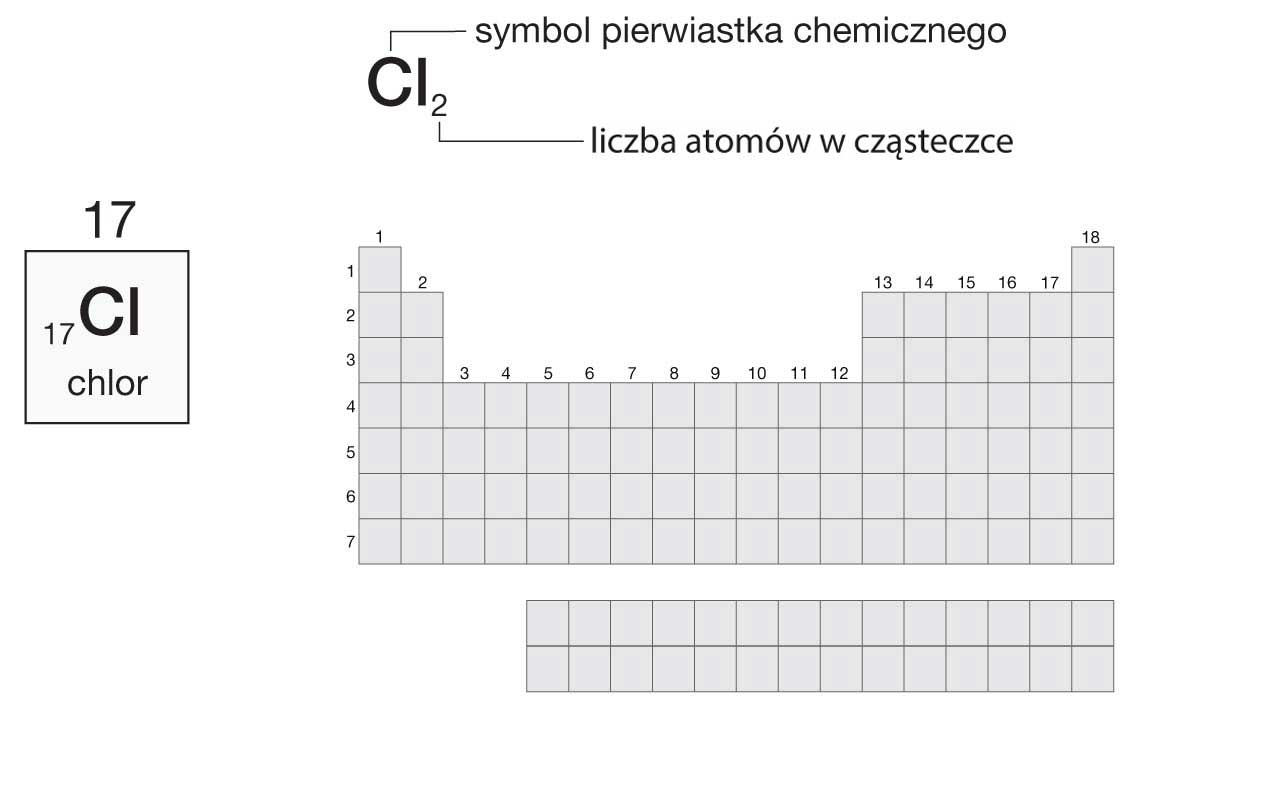
Cząsteczka chloru
Cząsteczka chloru składa się z 2 atomów chloru.
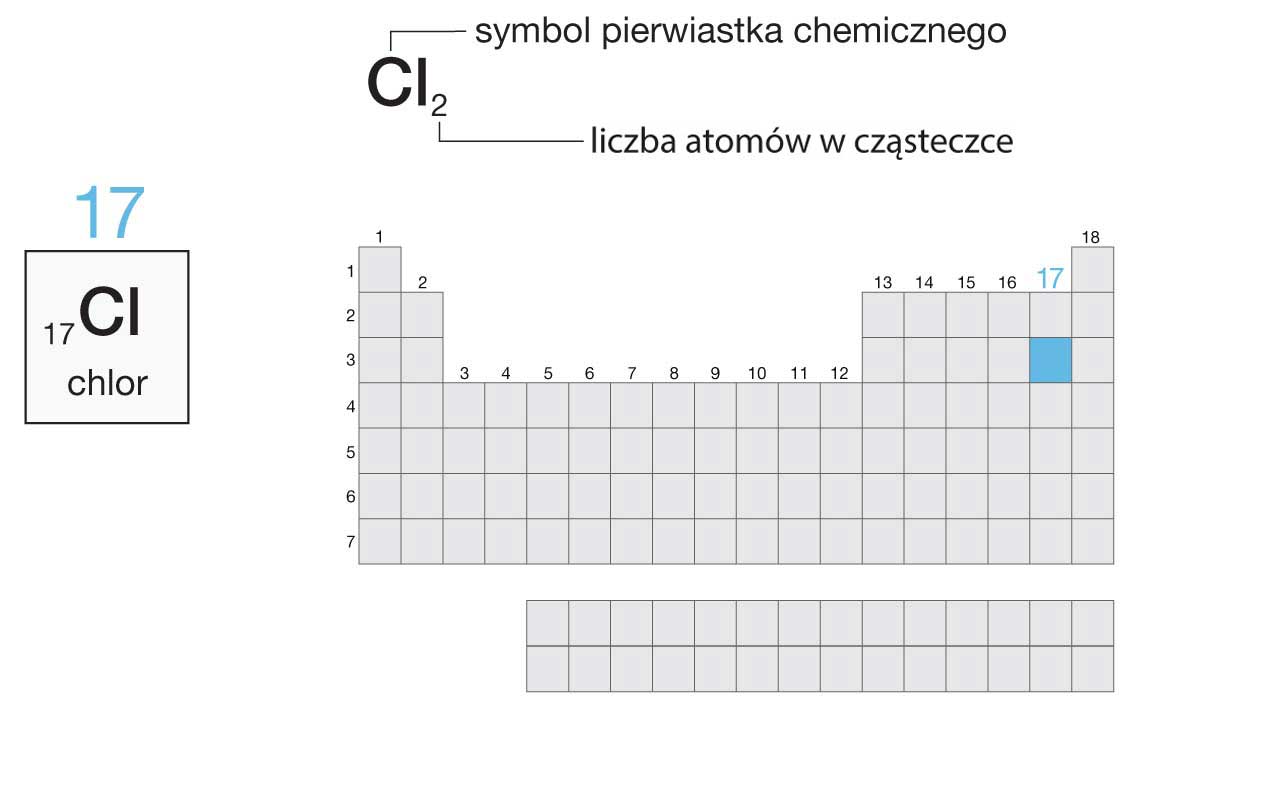
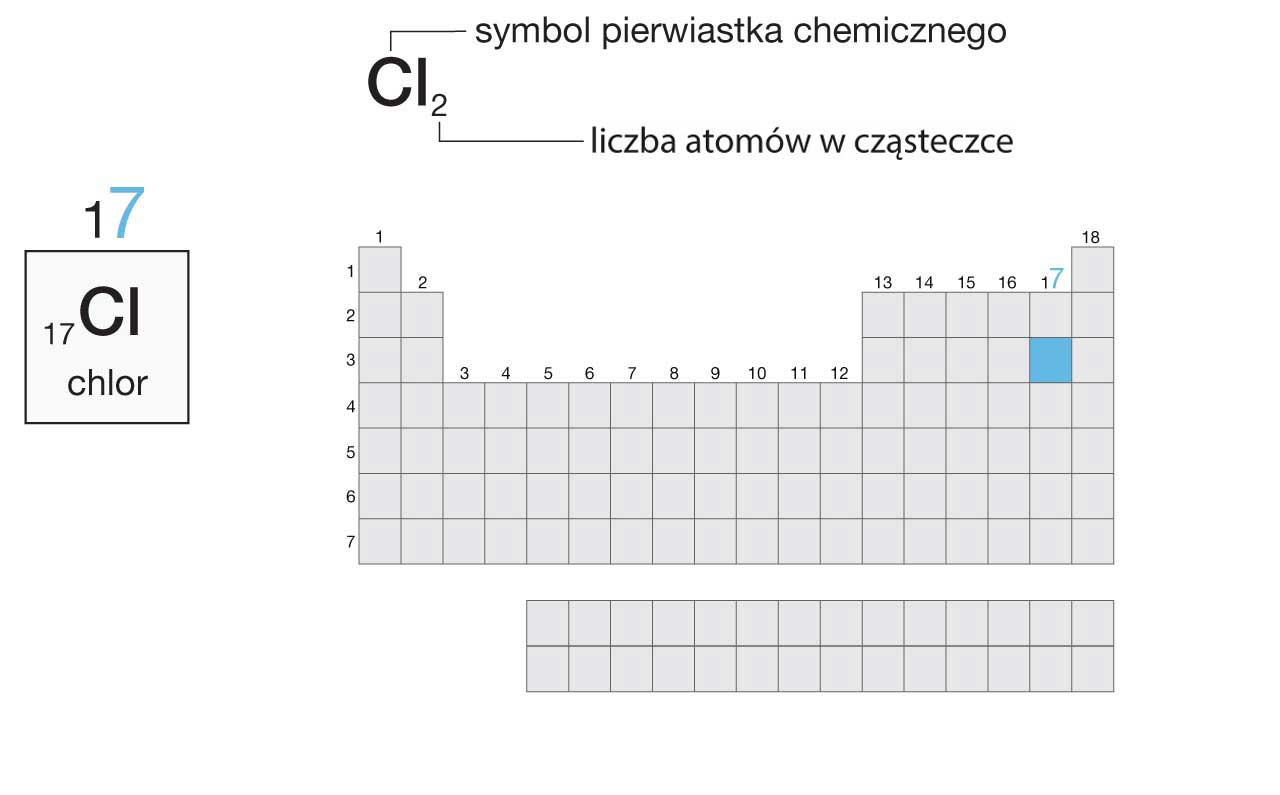
Chlor znajduje się w 17. grupie układu okresowego pierwiastków chemicznych, więc atom chloru ma 7 elektronów walencyjnych.
numer grupy układu okresowego
liczba elektronów walencyjnych
dla grup 13.–18.
liczba elektronów walencyjnych = numer grupy – 10
liczba elektronów walencyjnych atomu chloru = 7
- Ilu elektronów brakuje atomowi chloru, aby mógł uzyskać oktet elektronowy?
1 elektronu
2 elektronów
Oktet elektronowy to 8 elektronów walencyjnych. Atom chloru ma 7 elektronów walencyjnych, więc potrzebuje jeszcze 1 elektronu do oktetu.Atom chloru ma 7 elektronów walencyjnych, więc potrzebuje jeszcze jednego elektronu do oktetu. - Ile wspólnych par elektronowych musi wytworzyć się między atomami chloru, aby powstał oktet elektronowy?
1 para
2 pary
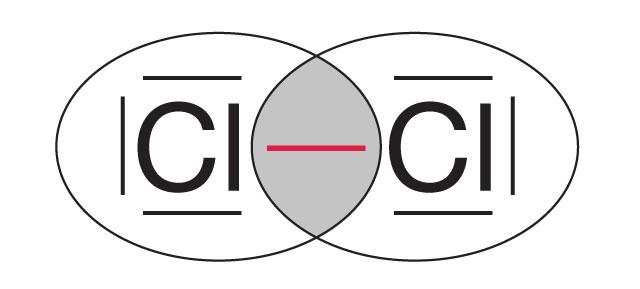
Każdy z atomów chloru potrzebuje 1 elektronu, aby uzyskać oktet. Dlatego między atomami wytworzy się 1 wspólna para elektronowa.Oktet elektronowy powstanie, gdy wytworzy się 1 wspólna para elektronowa. - Schemat powstawania wiązania w cząsteczce chloru
Uwspólnione elektrony
Wspólna para elektronowa
Elektrony tworzące oktet elektronowy
Wzór strukturalny
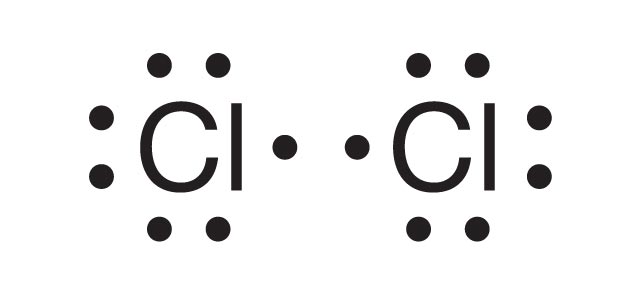

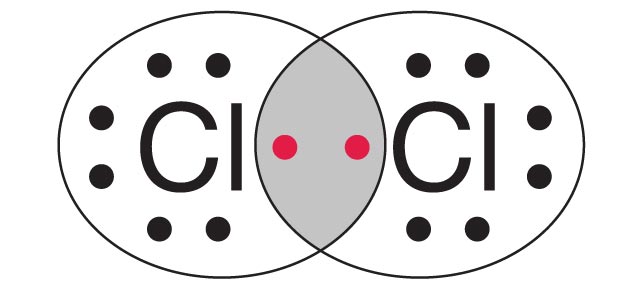

Liczba par elektronowych:
- w cząsteczce: 2e– tworzą 1 wspólną parę elektronową
- w atomie: 6e– tworzy 3 wolne pary elektronowe
Oznaczenia elektronów:
• elektrony tworzące wspólną parę elektronową
• elektrony tworzące wolne pary elektronowe
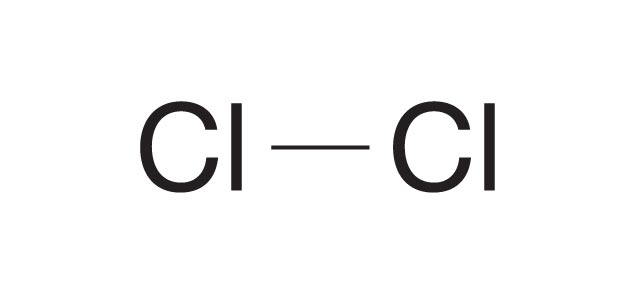
Uwspólnione elektrony
Wspólna para elektronowa
Elektrony tworzące oktet elektronowy
Wzór strukturalny
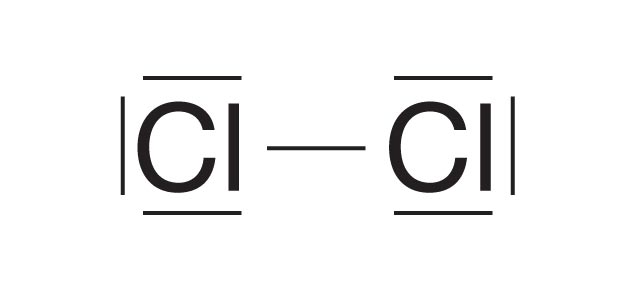
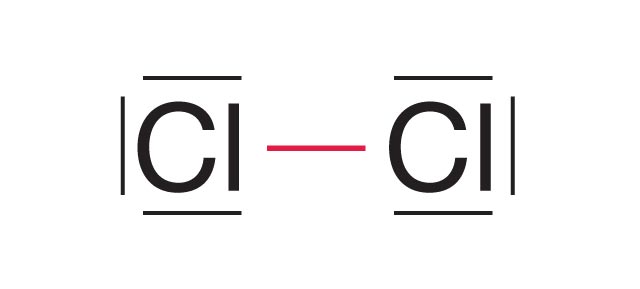
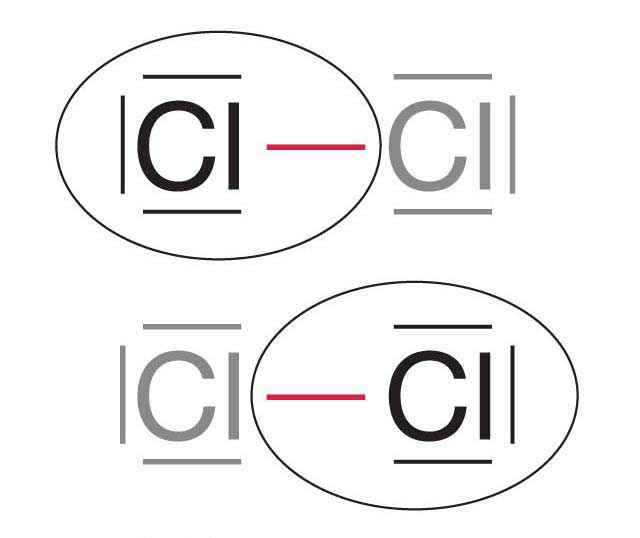
Liczba par elektronowych:
- w cząsteczce: 2e– tworzą 1 wspólną parę elektronową
- w atomie: 6e– tworzy 3 wolne pary elektronowe
Oznaczenia elektronów:
— wspólna para elektronowa
— wolna para elektronowa
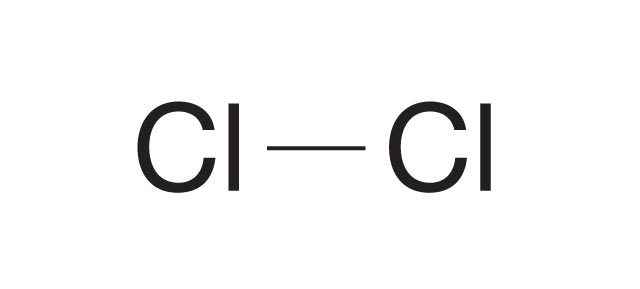
- Powstawanie wiązania kowalencyjnego niespolaryzowanego – symulacja